28/08/2021 17:12
Ngày mai sẽ họp, xem xét cấp phép vaccine COVID-19 Nano Covax
Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, Bộ Y tế cho biết ngày mai 29/8 sẽ xem xét họp cấp phép cho 2 loại vaccine, có Nano Covax.
Cuộc họp sẽ diễn ra cả ngày mai, 29/8, để xem xét cấp phép cho 2 loại vaccine COVID-19. Trong đó, có 1 loại vaccine nhập khẩu và 1 loại vaccine của Việt Nam là Nano Covax.
Vào ngày 27/8, Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia, cho biết đã chấp thuận kết quả thử nghiệm lâm sàng giai đoạn 3a đối với vaccine Nano Covax.
Ngay sau khi được chấp thuận, hồ sơ và dữ liệu nghiên cứu của vaccine Nano Covax được chuyển sang Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc (Bộ Y tế) để xem xét trước khi Bộ Y tế có quyết định cấp phép khẩn cấp có điều kiện với vaccine Nano Covax.
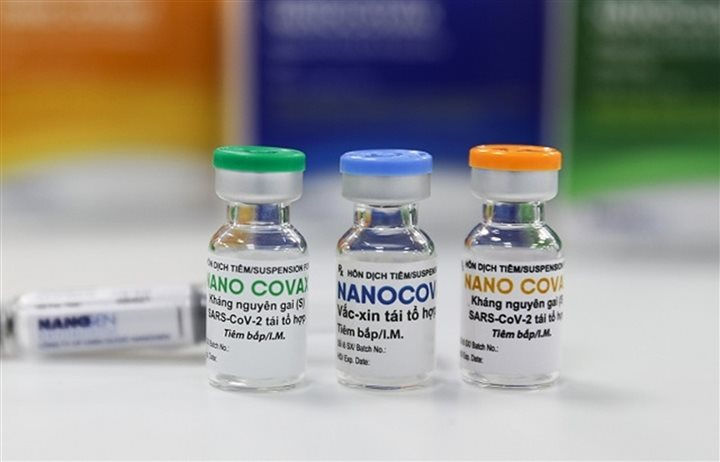
Theo quy định, Hội đồng tư vấn họp xem xét để cấp phép sau khi Hội đồng Đạo đức có biên bản nghiệm thu kết quả thử nghiệm và nghiên cứu liên quan tới Nano Covax.
Thời gian để cấp giấy đăng ký cho một loại vaccine đủ điều kiện lưu hành là trong vòng 20 ngày. Tuy nhiên, nếu vaccine Nano Covax đảm bảo mọi yêu cầu đặt ra, thời gian cấp phép có thể ngắn hơn, thậm chí chỉ trong vòng dưới 1 tuần.
Hiện tại, theo Thông tư 11 mới ban hành của Bộ Y tế thì vaccine đủ điều kiện được cấp phép khẩn cấp có điều kiện khi đang thử nghiệm lâm sàng và có kết quả thử nghiệm giai đoạn 3. Kết quả này được đánh giá về tính an toàn và hiệu quả bảo vệ của vaccine trên dữ liệu về tính sinh miễn dịch.
Vaccine COVID-19 Nano Covax do Công ty Cổ phần Công nghệ sinh học dược Nanogen phối hợp với Học viện Quân y nghiên cứu và sản xuất đang thử nghiệm giai đoạn 3. Đây là vaccine đầu tiên của Việt Nam thử nghiệm lâm sàng trên người dựa trên công nghệ tái tổ hợp protein và là 1 trong 15 vaccine ngừa COVID-19 trên thế giới đang thử nghiệm lâm sàng giai đoạn 3.
Công ty Nanogen bắt đầu những nghiên cứu vaccine Nano Covax từ tháng 3/2020. Đến tháng 7/2020 công ty hoàn tất mọi thứ liên quan tiền lâm sàng. Từ tháng 7/2020 đến nay là quá trình hoàn tất các thủ tục, công đoạn, kiểm định lâm sàng theo quy chuẩn Bộ Y tế và tiêm thử nghiệm trên người.
Vaccine được kiểm tra trên mô hình chuột lang, chỉ tiêu gây sốt kiểm tra trên thỏ; chỉ tiêu độc tố, tuân theo Dược điểm châu Âu, để đảm bảo khi tiêm vào người không gây sốt, gây độc.
Nano Covax được sản xuất qua 8 công đoạn, gồm: Vô trùng trang thiết bị, bao bì chứa; cân và pha chế; chiết rót và kiểm tra; siết nắp nhôm; soi cảm quan; in mã và cuối cùng là đóng gói thành phẩm. Tất cả công đoạn đều tuân theo quy trình nghiêm ngặt và đảm bảo an toàn tuyệt đối.
Bộ Y tế vừa có quyết định phân bổ vaccine AstraZeneca cho 62 tỉnh, thành phố và các đơn vị liên quan, với tổng cộng hơn 1,7 triệu liều từ nguồn VNVC nhập khẩu và Cộng hòa Ba Lan tài trợ.
Theo đó 28 tỉnh từ Hà Tĩnh trở ra miền Bắc tiếp nhận 448.400 liều. Trong đó, Thanh Hóa được phân bổ nhiều nhất với 112.800 liều, Hà Nội có 58.000 liều, Nghệ An 50.000 liều, Hải Dương 30.000 liều…
11 tỉnh, thành phố còn lại ở miền Trung được phân bổ 124.100 liều. Các tỉnh Tây Nguyên nhận 25.000 liều.
Khu vực phía nam, 19 tỉnh, thành phố được phân bổ 263.000 liều. Trong đó, Long An, Đồng Nai, Bình Dương nhận 30.000 liều, Cần Thơ có 24.000 liều. Lực lượng công an và quân đội lần lượt được phân bổ 300.000 và 400.000 liều AstraZeneca.
Cũng trong quyết định phân bổ này, 28 viện, bệnh viện, trung tâm thuộc Bộ Y tế và các bộ, ngành được phân đó 149.200 liều vaccine. Lần này, Viện Vệ sinh dịch tễ Trung ương nhận 20.000 liều, Bệnh viện Thống nhất, Bệnh viện Đại học Y dược TP.HCM , Bệnh viện Chợ Rẫy… cùng được phân bổ 7.000 liều.
Chủ đề liên quan
Advertisement
Advertisement
Đọc tiếp













