11/07/2022 11:45
Phát hiện 2 lô thuốc kháng sinh giả, Bộ Y tế yêu cầu thu hồi
Cục Quản lý Dược vừa thông báo yêu cầu Sở Y tế các địa phương thu hồi ngay 2 lô thuốc Cefuroxim 500mg giả.
Theo đó, Trung tâm kiểm nghiệm Hà Giang lấy mẫu thuốc Viên nén bao phim Cefuroxim 500mg, SĐK: VD-31978-19, lô SX: 3490621, NSX: 010621, HD: 010624; cơ sở sản xuất ghi trên nhãn: Chi nhánh Công ty cổ phần dược phẩm Trung ương Vidipha Bình Dương. Mẫu thuốc được lấy tại một cửa hàng ở huyện Bắc Quang.
Viện Kiểm nghiệm thuốc TP.HCM cũng báo cáo về mẫu sản phẩm trên nhãn ghi như trên, chỉ khác lô sản xuất (5241121), ngày sản xuất (301121) và hạn dùng (301124).
Mẫu do Trung tâm kiểm nghiệm thuốc, mỹ phẩm, thực phẩm Tiền Giang lấy tại Quầy thuốc số 28 xã Tân Hương, Châu Thành.
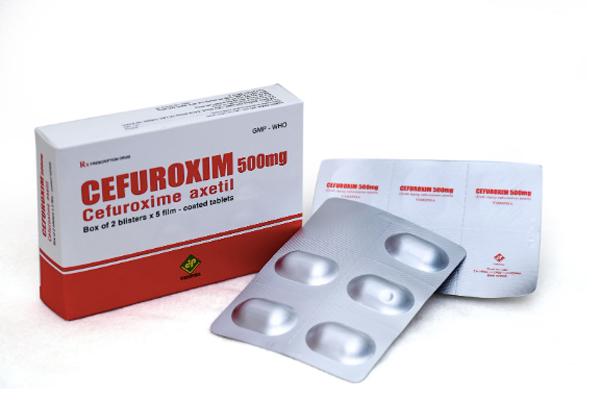
Mẫu thuốc Cefuroxim 500mg thật. Ảnh: Công ty cổ phần dược phẩm Trung ương Vidipha
Cả hai mẫu được lấy tại Bắc Quang (Hà Giang) và Châu Thành (Tiền Giang) đều không đạt tiêu chuẩn chất lượng về các chỉ tiêu định tính, định lượng, cụ thể là không có hoạt chất.
Cục Quản lý Dược đã đối chiếu mẫu thuốc do Công ty Vidipha sản xuất với mẫu sản phẩm do Trung tâm kiểm nghiệm Hà Giang cung cấp có dấu hiệu khác nhau không rõ ràng, chỉ phân biệt được khi để cạnh nhau.
Để đảm bảo an toàn cho người sử dụng, Cục Quản lý Dược thông báo thu hồi toàn quốc 2 lô thuốc trên nhãn ghi: Viên nén bao phim Cefuroxim 500mg, SĐK: VD-31978-19, gồm 2 lô: SX 5241121, NSX: 301121, HD: 301124 và lô 3490621, NSX: 010621, HD: 010624; Chi nhánh Công ty cổ phần dược phẩm Trung ương Vidipha Bình Dương.
Cục Quản lý Dược yêu cầu Chi nhánh Công ty cổ phần dược phẩm Trung ương Vidipha Bình Dương phải gửi thông báo tới các cơ sở bán buôn, bán lẻ, sử dụng thuốc về việc thu hồi 2 lô thuốc trên và tiến hành thu hồi toàn bộ lô thuốc nêu trên, gửi báo cáo thu hồi về Cục Quản lý Dược trong vòng 18 ngày.
Sở Y tế các địa phương, Y tế các ngành cần thông báo cho các cơ sở kinh doanh, người sử dụng thuốc về việc thu hồi, không tiếp tục sử dụng, trả lại cho đơn vị cung cấp đối với 2 lô thuốc nêu trên.
Riêng Sở Y tế Bình Dương được yêu cầu kiểm tra và giám sát Chi nhánh Công ty cổ phần dược phẩm Trung ương Vidipha Bình Dương thực hiện việc thu hồi và xử lý thuốc bị thu hồi theo quy định.
Cefuroxim 500mg thuộc nhóm kháng sinh cephalosporin, được chỉ định trong các trường hợp nhiễm khuẩn như viêm đường tiết niệu, viêm đường hô hấp, nhiễm khuẩn tiêu hóa...
Cục Quản lý Dược vừa quyết định thu hồi Giấy đăng ký lưu hành thuốc tại Việt Nam đối với thuốc Zinnat Suspension, Số GĐKLH: VN-20513-17.
Sản phẩm do Công ty GlaxoSmithKline Pte., Ltd ở Singapore đăng ký; Nhà sản xuất là Glaxo Operations UK Limited, địa chỉ ở Anh.
Theo Cục Quản lý Dược, lý do thu hồi Giấy đăng ký lưu hành thuốc tại Việt Nam đối với thuốc Zinnat Suspension là vì thuốc có 2 lô bị thu hồi do vi phạm chất lượng mức độ 2.
Trước đó, hồi tháng 5, Cục này đã có thông báo đến Sở Y tế các tỉnh, thành phố về việc thu hồi thuốc vi phạm mức độ 2 các lô thuốc kháng sinh cốm pha hỗn dịch uống Zinnat Suspension 125mg (Cefuroxim axetil 125mg).
Đây là kháng sinh thuộc nhóm thuốc trị ký sinh trùng, chống nhiễm khuẩn, kháng virus, kháng nấm được chỉ định cho những trường hợp: Nhiễm khuẩn ở đường hô hấp trên và dưới; Nhiễm khuẩn hệ tiết niệu sinh dục; Nhiễm khuẩn bề mặt da và các cấu trúc của mô mềm…
Tin liên quan
Advertisement
Advertisement










